|
一、项目名称:保健食品审批
二、许可内容:进口(含港、澳、台)保健食品产品注册
三、实施依据:《中华人民共和国食品卫生法》、《保健食品注册管理办法(试行)》、《保健食品行政许可受理审查要点》
四、收费:不收费
五、数量限制:本许可事项无数量限制
六、申请人提交材料目录:
资料编号(一)进口保健食品注册申请表;
资料编号(二)申请人身份证、营业执照或者其它机构合法登记证明文件的复印件;
资料编号(三)提供申请注册的保健食品的通用名称与已经批准注册的药品名称不重名的检索材料(从国家食品药品监督管理局政府网站数据库中检索);
资料编号(四)申请人对他人已取得的专利不构成侵权的保证书;
资料编号(五)提供商标注册证明文件(未注册商标的不需提供);
资料编号(六)产品研发报告(包括研发思路,功能筛选过程,预期效果等);
资料编号(七)产品配方(原料和辅料)及配方依据;
资料编号(八)功效成分/标志性成分、含量及功效成分/标志性成分的检验方法;
资料编号(九)生产工艺简图及其详细说明和相关的研究资料;
资料编号(十)产品质量标准及其编制说明(包括原料、辅料的质量标准);
资料编号(十一)直接接触产品的包装材料的种类、名称、质量标准及选择依据;
资料编号(十二)检验机构出具的试验报告及其相关资料;
资料编号(十三)产品标签、说明书样稿;
资料编号(十四)产品技术要求及产品技术要求上传成功确认单;
资料编号(十五)其他有助于产品评审的资料;
资料编号(十六)两个未启封的最小销售包装的样品;
资料编号(十七)功能不在国家食品药品监督管理局公布的功能项目范围内的,还需按照相关要求提供资料;
资料编号(十八)生产国(地区)有关机构出具的该产品生产企业符合当地相应生产质量管理规范的证明文件;
资料编号(十九)由境外厂商常驻中国代表机构办理注册事务的,应当提供《外国企业常驻中国代表机构登记证》复印件;境外生产厂商委托境内的代理机构负责办理注册事项的,需提供经过公证的委托书原件以及受委托的代理机构营业执照复印件;
资料编号(二十)产品在生产国(地区)生产销售一年以上的证明文件,该证明文件应当经生产国(地区)的公证机关公证和驻所在国中国使领馆确认;
资料编号(二十一)生产国(地区)或国际组织的与产品相关的有关标准;
资料编号(二十二)产品在生产国(地区)上市使用的包装、标签、说明书实样,实样应排列于标签、说明书样稿项下;
资料编号(二十三)连续三个批号的样品,其数量为检验所需量三倍。
七、对申报资料的要求:
(一)申报资料的一般要求:
1、申报资料首页为申报资料项目目录,目录中申报资料项目按《保健食品注册申请表》中“所附资料”顺序排列。每项资料加封页,封页上注明产品名称、申请人名称,右上角注明该项资料名称。各项资料之间应当使用明显的区分标志,并标明各项资料名称或该项资料所在目录中的序号。整套资料用打孔夹装订成册。
2、申报资料使用A4规格纸张打印(中文不得小于宋体小4号字,英文不得小于12号字),内容应完整、清楚,不得涂改。
3、新产品注册申请应提交申报资料原件1份、复印件8份。复印件应当与原件完全一致,应当由原件复制并保持完整、清晰。
4、除《进口保健食品注册申请表》及检验机构出具的检验报告外,申报资料应逐页加盖申请人印章或骑缝章(多个申请人联合申报的,应加盖所有申请人印章),印章应加盖在文字处。加盖的印章应符合国家有关用章规定,并具法律效力。进口保健食品申请人若无印章,可以法定代表人签字或者盖签名章代替。
5、多个申请人联合申报的,应提交联合申报负责人推荐书。
6、申报资料中同一内容(如产品名称、申请人名称、申请人地址等)的填写应前后一致。电子版与文字版的同一内容(产品名称、申请人名称、申请人地址、产品配方、试制单位名称、试制单位地址、试验单位名称、产品受理编号)应当一致。
7、产品配方、生产工艺、质量标准、标签与说明书及有关证明文件中的外文,均应译为规范的中文;外文参考文献中的摘要、关键词及与产品保健功能、安全有关部分的内容应译为规范的中文(外国人名、地址除外)。
8、非首次申请的申报资料应提供撤审通知书或不予批准通知书复印件(加盖申请人公章),还应提供再次申报的理由,附于申报资料的首页。
(二)申报资料的具体要求:
1、进口保健食品注册申请表。
(1)进口保健食品注册申请表可从国家食品药品监督管理局网站(www.sfda.gov.cn)或国家食品药品监督管理局保健食品审评中心网站(www. bjsp.gov.cn)下载。
(2)填写前应认真阅读填表须知,按要求填写。
(3)申请表内容须打印填写,项目填写应完整、规范,不得涂改。
(4)申报的保健功能应与国家食品药品监督管理局公布的保健食品功能名称一致。申报的新功能除外。
(5)进口保健食品申请人为产品所有权的拥有者,生产企业为产品的实际生产者(申报产品由申请人自行生产的,生产企业即为申请人;申报产品由申请人委托境外其它企业生产的,生产企业即为被委托企业)。
(6)产品名称应包括品牌名、通用名和属性名。
2、申请人身份证、营业执照或者其它机构合法登记证明文件的复印件。提供的复印件应清晰、完整,加盖印章。
3、申请注册的保健食品的通用名称与已经批准注册的药品名称不重名的检索材料。
(1)不重名检索说明。
(2)提供从国家食品药品监督管理局政府网站数据库中检索申请注册的保健食品的通用名称与已经批准注册的药品名称不重名的网页打印。
4、申请人对他人已取得的专利不构成侵权的保证书。
申请人提供的保证书应当包括有关该保健食品的专利查询情况,以证明该申请不涉及侵犯他人已有的专利权,并保证不侵犯他人专利权,承诺对可能的侵权后果承担全部责任。
5、商标注册证明文件(未注册商标的不需提供)。
商标注册证明文件,是指国家商标注册管理部门批准的商标注册证书复印件,未注册的不需提供。商标使用范围应包括保健食品,商标注册人与申请人不一致的,应提供商标注册人变更文件或申请人可以合法使用该商标的证明文件。提供的复印件应清晰、完整,加盖印章。
6、产品研发报告(包括研发思路,功能筛选过程,预期效果等)。包括研发思路、功能筛选过程、预期效果三方面内容,各项内容应分别列出,缺一不可。
7、产品配方(原料和辅料)及配方依据。
(1)产品配方(原料和辅料)。
(2)配方依据。
(3)按规定配方表示格式列出原辅料名称及其用量。
(4)产品配方(原料和辅料)、配方依据应分别列出,内容应完整。
8、功效成分/标志性成分、含量及功效成分/标志性成分的检验方法。
功效成分/标志性成分、含量及功效成分/标志性成分的检验方法三方面内容应分别列出,不可缺项。
9、生产工艺简图及其详细说明和相关的研究资料。
(1)生产工艺简图及其详细说明和相关的研究资料三方面资料应分别列出,不可缺项,内容应一致。
(2)生产工艺简图应包含所有的生产工艺路线、环节,注明所有的工艺过程和相关技术参数。
(3)生产工艺说明应当细描述生产工艺,包括产品生产过程的所有环节以及各环节的工艺技术参数;注明相应环节所用设备及型号;以提取物为原料的,提供该提取物的生产工艺。
(4)相关的研究资料。
(5)3批样品检验报告。
(6)应用大孔吸附树脂分离纯化工艺生产的保健食品应符合《应用大孔吸附树脂分离纯化工艺生产的保健食品申报与审评规定(试行)》。
10、产品质量标准及其编制说明(包括原料、辅料的质量标准)。
(1)企业标准中涉及到申请人名称,应与申请表中申请人名称一致。
(2)企业标准中附录按规定逐项列出,内容应完整、齐全。
11、直接接触产品的包装材料的种类、名称、质量标准及选择依据。
(1)提供包装材料的名称(种类)、质量标准。
(2)提供包装材料的来源证明材料。
(3)提供包装材料的选择依据。
12、检验机构出具的试验报告及其相关资料。
(1)出具检验报告的检验机构应为国家食品药品监督管理局确定的保健食品检验机构。检验报告有效期为自检验机构签发之日起的5年内,超过有效期的检验报告不予受理。
(2)试验报告按下列顺序排列:
①检验申请表(附在相应的试验报告之前)。
②检验单位的检验受理通知书(附在相应的试验报告之前)。
③安全性毒理学试验报告。
④功能学试验报告(包括动物的功能试验报告和/或人体试食试验报告)。
⑤兴奋剂、违禁药物检验报告(申报缓解体力疲劳、减肥、改善生长发育功能的注册申请)。
⑥功效成分或标志性成分试验报告。
⑦稳定性试验报告。
⑧卫生学试验报告。
⑨其他检验报告(如原料品种鉴定报告、菌种毒力试验报告等)。
(3)检验报告应符合下列要求:
①检验报告格式应规范,不得涂改。
②检验机构法人代表(或其授权人)签名并加盖检验机构公章。
③检验报告除在检验结论处加盖检验机构公章外,一页以上的检验报告必须加盖骑缝章或逐页加盖公章。
(4)检验报告中产品名称、送检单位、样品生产或试制单位名称、样品批号应与检验申请表中相应内容一致。若有变更,申请人和检验机构需提供书面说明。
(5)营养素补充剂保健食品的注册申请,不需提供功能学试验报告;不提供安全性毒理学试验报告的,必须书面说明理由。
(6)申报资料中应当增加伦理委员会出具的允许开展该人体试食试验证明文件的复印件。复印件须加盖检验机构印鉴,附于人体试食试验报告后。
(7)同一申请人申请原料和主要辅料相同、剂型不同产品的注册,申请人应当提供不同剂型选择的科学、合理的依据。如果其中一个剂型的产品注册已经提供所有的检验报告,其他剂型的产品注册时可以免做安全性毒理学和功能学试验,但需提供免做相关试验的说明,以及已做所有试验产品的安全性毒理学和功能学试验报告复印件。
(8)保健食品原料与主要辅料相同,涉及不同口味、不同颜色的产品注册,如果其中一种口味、颜色的产品注册已经提供所有试验报告,其他口味和颜色的产品注册可以免做安全性毒理学和功能学试验,但需提供免做相关试验的说明,以及已做所有试验产品安全性毒理学和功能学试验报告复印件。
13、产品标签、说明书样稿。
产品标签、说明书样稿应按《保健食品注册申报资料项目要求(试行)》提供该项资料。
保健食品的适宜人群、不适宜人群、注意事项应根据申报的保健功能和产品的特性确定,按《保健食品申报与审评补充规定(试行)》提供该项资料。
14、产品技术要求及产品技术要求上传成功确认单。
15、生产国(地区)有关机构出具的该产品生产企业符合当地相应生产质量管理规范的证明文件。
(1)申报产品由申请人委托境外生产企业生产的,证明文件中的生产企业应为被委托生产企业,同时需提供申请人委托生产的委托书。
(2)证明文件中应载明出具文件机构名称、产品名称、生产企业名称和出具文件的日期。
(3)出具该证明文件的机构应是产品生产国主管部门或行业协会。
16、由境外厂商常驻中国代表机构办理注册事务的,应当提供《外国企业常驻中国代表机构登记证》复印件。
境外生产厂商委托境内的代理机构负责办理注册事项的,需提供经过公证的委托书原件及受委托的代理机构营业执照复印件。
委托办理注册事务的委托书应符合下列要求:
(1)委托书应载明委托书出具单位名称、受委托单位名称、委托申请注册产品名称、委托事项和委托书出具日期。
(2)出具委托书的委托方应与申请人名称完全一致。
(3)被委托方再次委托其它代理机构办理注册事务时,应提供申请人的认可文件原件及中文译本,译文需经中国境内公证机关公证。
17、产品在生产国(地区)生产销售一年以上的证明文件,该证明文件应当经生产国(地区)的公证机关公证和驻所在国使领馆确认。
产品在生产国(或地区)生产销售一年以上的证明文件,应符合以下要求:
(1)证明文件应载明文件出具机构的名称、申请人名称、生产企业名称、产品名称和出具文件的日期。
(2)证明文件应当明确标明该产品符合该国家(或地区)法律和相关标准,允许在该国(或地区)生产和销售,如为只准在该国(或地区)生产,不在该国(地区)销售,这类产品注册申请不予受理。
(3)出具证明文件的机构应是生产国政府主管部门或行业协会。
18、生产国(地区)或国际组织的与产品相关的有关标准。
19、产品在生产国(地区)上市使用的包装、标签、说明书实样。应列于标签、说明书样稿项下。
20、其它有助于产品评审的资料。
(1)提供原料生产企业的合法登记文件。
(2)提供原料和辅料的检验报告。
(3)提供原料的购销发票。原料如属赠送的,应提供原料生产企业出具的相关证明,申请人向原料经销单位购买原料的,还需提供经销商与原料生产企业的供货协议复印件。
(4)以提取物为原料的,还应提供提取物的生产工艺及质量标准,并加盖供货商公章。
(5)提供申请人与样品试制单位的委托加工协议。
(6)提供样品试制单位的有效的营业执照、卫生许可证,卫生许可证包含申报产品的剂型。
(7)配方中使用了真菌、益生菌、核酸、濒危野生动植物、辅酶Q10、大豆异黄酮等已有明确规定的物品,除按照《保健食品注册管理办法(试行)》提供有关资料外,还应按照相应规定提供有关资料。
(8)以化学合成品为原料的产品,应提供可食用的依据、食用量及安全性评价资料。
(9)参考文献。
(10)首页应当提供注明该项下各项文件、资料名称和类别的目录,并使用明显的识别标志对各项文件、资料进行区分。
21、连续3个批号的样品,其数量为检验所需量3倍。
22、两个未启封的最小销售包装的样品。
提供的样品包装应完整、无损,应贴有标签,标签应与申报资料中相应的内容一致。样品包装应利于样品的保存,不易变质、破碎。样品应在保质期内。
23、上述申报资料必须使用中文并附原文,外文的资料可附后作为参考。中文译文应当由境内公证机关进行公证,确保与原文内容一致;申请注册的产品质量标准(中文本),必须符合中国保健食品质量标准的格式。
24、还应当注意以下事项:
(1)产品注册申请表中,进口产品申请人为产品所有权的拥有者,生产企业为产品的实际生产者(申报产品由申请人自行生产的,生产企业即为申请人;申报产品由申请人委托境外其他企业生产的,生产企业即为被委托企业)。
(2)产品名称、申请人名称、生产企业名称、代理机构名称(中、英文)应前后一致。
(3)证明文件、委托书应为原件,应使用生产国(或地区)的官方文字,需由所在国(或地区)公证机关公证和我国驻所在国使(领)馆确认。
(4)证明文件、委托书中载明有效期的,应当在有效期内使用。
(5)证明文件、委托书应有单位印章或法人代表(或其授权人)签字。
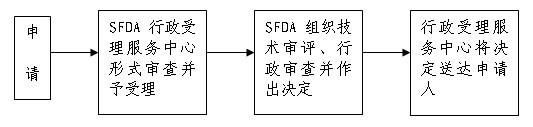
八、申办流程示意图:
九、许可程序:
(一)受理:
申请人向行政受理服务中心提出申请,按照本《须知》第六条所列目录提交申请材料,受理中心工作人员按照“《保健食品注册管理办法》附件一:进口保健食品产品注册申请申报资料项目”对申请材料进行形式审查。申请事项依法不需要取得行政许可的,应当即时告知申请人不受理;申请事项依法不属于本行政机关职权范围的,应当即时作出不予受理的决定,并告知申请人向有关行政机关申请;申请材料存在可以当场更正的错误的,应当允许申请人当场更正;申请材料不齐全或者不符合法定形式的,应当当场或者在五日内一次告知申请人需要补正的全部内容,逾期不告知的,自收到申请材料之日起即为受理;申请事项属于本行政机关职权范围,申请材料齐全、符合法定形式,或者申请人按照本行政机关的要求提交全部补正申请材料的,应当受理行政许可申请。
(二)检验与核查:
行政受理服务中心受理后,国家食品药品监督管理局在5日内向确定的检验机构发出检验通知书并提供检验用样品。根据需要,国家局可以对该产品的生产现场和试验现场进行核查。
检验机构收到检验通知书和样品在50日内对抽取的样品进行样品检验和复核检验,将检验报告移送国家食品药品监督管理局,同时抄送申请人。特殊情况,检验机构不能在规定的时限内完成检验工作的,应当及时向国家食品药品监督管理局报告并书面说明理由。
(三)技术审评和行政审查:
国家食品药品监督管理局在受理申请后,应当在80日内对申报资料进行技术审评和行政审查,并作出许可决定。在审查过程中,需要补充资料的,国家食品药品监督管理局应当一次性提出。申请人应当在收到补充资料通知书后的5个月内提交符合要求的补充资料,未按规定时限提交补充资料的予以退审。特殊情况,不能在规定时限内提交补充资料的,必须向国家食品药品监督管理局提出书面申请,并说明理由。国家食品药品监督管理局应当在20日内提出处理意见。申请人补充资料时间不计入许可时限,其审查时限在原审查时限的基础上延长30日。经审查准予注册的,发给《国产保健食品批准证书》。不予注册的,应当书面说明理由。
(四)送达:
自行政许可决定作出之日起10日内,SFDA行政受理服务中心将行政许可决定送达申请人。
(五)复审:
申请人对国家食品药品监督管理局作出的不予注册的决定有异议的,可以在收到不予注册通知之日起10日内向国家食品药品监督管理局提出书面复审申请并说明复审理由。
国家食品药品监督管理局收到复审申请后,应当按照原申请事项的审查时限和要求进行复审,并作出复审决定。撤销不予注册决定的,向申请人颁发相应的保健食品批准证明文件;维持原决定的,不再受理再次的复审申请,但申请人可按照有关法律规定,向国家食品药品监督管理局申请行政复议或者向人民法院提起行政诉讼。
十、承诺时限:
自受理之日起,85日内作出行政许可决定。
十一、实施机关:
实施机关:国家食品药品监督管理局
受理地点:国家食品药品监督管理局行政受理服务中心
十二、许可证件有效期与延续:
《进口保健食品批准证书》有效期为5年,《进口保健食品批准证书》有效期届满需要延长有效期的,申请人应当在有效期届满三个月前申请再注册。
十三、许可年审或年检:无
十四、受理咨询与投诉机构:
咨询:国家食品药品监督管理局
投诉:国家食品药品监督管理局驻局监察局、政策法规司执法监督处
注:本须知工作期限以工作日计算,不含法定节假日 |  ;微信:tianjianhuacheng
;微信:tianjianhuacheng


